Avril 2006 - n°109
Séparations peptidiques par chromatographie
d’échange cationique avec Luna SCX
Scott Waite et Michael McGinley
Phenomenex SAS - Parc des Grillons, Bat 3 - 60 route de Sartrouville - 78232
Le Pecq Cedex - France
Introduction
Alors que la chromatographie à polarité de phase inversée
est le choix traditionnel pour les séparations peptidiques, d’autres
modes de séparation peuvent apporter des informations supplémentaires
et une sélectivité différente. Un autre mode(1) de séparation
populaire pour les séparations peptidiques est la chromatographie d’échange
ions utilisant une colonne soit d’échange cationique fort (Strong
Cation Exchange – SCX) soit d’échange anionique faible
(Weak Anion Exchange– WAX).
Les modifications peptidiques comme la désamidation et l’acétylation
ne sont pas toujours observées par traçage peptidiqueà
polarité de phase inversée, mais peuvent souvent être
observées en utilisant la chromatographie d’échange d’ions.
Dans le domaine de la protéomique, la chromatographie bidimensionnelle
est souvent employée pour séparer les mélanges peptidiques
très complexes(2).
De telles techniques utilisent la chromatographie d’échange d’ions
pour la première séparation dimensionnelle suivie de la phase
inversée LC-MS/MS pour l’identification des peptides.
« Les peptides qui diffèrent par une seule charge sont facilement
séparés par cette méthode. Ceci illustre la capacité
à séparer les peptides présentant seulement de légères
différences d’hydrophobicité »
Le mécanisme de séparation de la chromatographie d’échange
d’ions est basé sur des différences de charge entre les
peptides. L’échantillon est chargé dans une phase mobile
à faible concentration ionique et est élué en augmentant
la concentration ionique de la phase mobile. Ce processus est habituellement
effectué par l’intermédiaire d’un gradient avec
une salinité en augmentation. D’autres paramètres, tels
que le pH et le solvant organique, sont employés pour modifier le pouvoir
de rétention de différents composés. Dans l’échange
cationique, une augmentation de pH diminue la charge positive nette des peptides
menantà une liaison plus faible et des temps de rétention plus
courts. Les modificateurs organiques (tels que l’acétonitrile
ou le méthanol) agissent également sur le pouvoir de rétention
des peptides en réduisant les interactions hydrophobes.
Dans ces notes d’application, nous avons effectué des séparations
peptidiques en utilisant Luna SCX (colonne à taille de pore 100Å
à base de silice). Pour démontrer les possibilités de
cette phase, nous avons utilisé un mélange de peptides et de
peptides issus de la digestion tryptique d’une protéine.
Instrumentation & Équipement
Pour les analyses, nous avons utilisé un système HP
1100 LC (Agilent Technologies, Palo Alto, CA, Etats-Unis) équipé
d’une pompe quaternaire, d’un dégazeur intégré,
d’un détecteur d’onde multilongueur, et d’un échantillonneur
automatique. Le logiciel de HP Chemstation (Version A.09.01) a été
utilisé pour l’analyse des données. La colonne HPLC (Chromatologie
Liquide Haute Performance) utilisée pour l’analyse était
une Luna 5µm SCX 150 x 4,6mm (Phenomenex, Torrance, CA, Etats-Unis).
Le cytochrome c bovin et les peptides de bradykinine ont été
obtenus chez Sigma Chemical (St Louis, MO, Etats-Unis). De la trypsine à
degré de séquençage modifié a été
obtenue chez Roche Applied Science (Indianapolis, IN, Etats-Unis).
L’acétonitrile de qualité HPLC, l’eau, et l’acide
trifluoroacétique ont été obtenus chez Fisher Scientific
(Springfield, NJ, Etats-Unis).

Chromatogramme d’échange ionique d’un
mélange peptidique. Le mélange est fait de quatre peptides différents
de bradykinine : fragment 2-7 de bradykinine, fragment 1-7 de bradykinine,
bradykinine d’Ile-Ser, et bradykinine intégrale. Les peptides
changent entre la charge 0 à +2 nette dans les conditions d’opération
(pH 2,5). Les peptides à charge positive plus élevée
s’éluent plus tard sur le chromatogramme, avec des concentrations
de salinité accrues.
Méthode expérimentale
Mélange de peptides de Bradykinine
Un mélange des peptides de bradykinine a été
reconstitué dans de l’eau et dilué avec une phase mobile
A avant l’injection. La composition de la phase mobile A était
de 20 mM de phosphate de potassium pH 2,5/acétonitrile (75/25). La
phase mobile B utilisée pour le mélange peptidique était
de 20 mM de phosphate de potassium pH 2,5/0,5 M de chlorure de potassium/
acétonitrile (75/25). La colonne a été équilibrée
avec 100% A avant l’injection d’échantillon. Le programme
de gradient consistait en une rampe linéaire de 0% B à B 100%
sur 30 minutes et la colonne a été rééquilibrée
avec 100% A avant les injections suivantes.
Produits digérés tryptiques de
Cytochrome c
Les peptides issus de la digestion tryptique ont été
obtenus comme suit : une partie aliquote de 100 µg du cytochrome c a
été dissoute dans 200 µl de 0,1 M de bicarbonate d’ammonium
pH 8,0 une partiealiquote de 4 µl de trypsine de 0,5 mg/ml a été
ajoutée (taux E/S 1:50) et incubéeà 37°C pendant
18 heures. La réaction a été arrêtée par
acidification avec 4 µl d’acide trifluoroacétique et l’échantillon
a été dilué avec de l’eau avant l’injection
sur HPLC. Une partie aliquote de 50 µl (20µg) du produit digéré
de cytochrome c a été injectée pour l’analyse par
traçage de peptide.
Pour un traçage de peptide, nous avons utilisé des conditions
HPLC similaires aux séparations peptidiques, excepté que la
phase mobile B était de 20 mM de phosphate de potassium pH 2,5/350
mM de chlorure de potassium/acétonitrile (75/25).
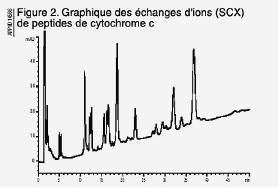
Chromatographe d’échange d’ions
d’une digestion tryptique du cytochrome C. Approximativement 20µg
ont été injectés sur la colonne Luna 5µm SCX 150
x 4,6. Notez la finesse des pics et la résolution des peptides.
En outre, le programme de gradient utilisé était une rampe linéaire
de 0% B à 100% B sur 50 minutes. Pour toutes les analyses, la température
de colonne a été maintenue à 35° C et le débit
était 1,0 ml/min pendant toute l’opération. L’élution
de l’échantillon a été surveillée par UV
à 215 nm.
Résultats et Discussion
Luna SCX est une colonne d’échange ions à base
de silice avec un groupe phénylique d’acide sulfonique comme
ligand réactif. La présence du groupe phényle donne au
milieu certaines caractéristiques de phase inversée et l’acétonitrile
peut alors être utilisé dans la phase mobile pour améliorer
la forme des pics. Les analyses HPLC d’un mélange de peptides
de bradykinine démontrent la capacité de Luna SCX à séparer
les peptides en se basant sur des différences de charge (figure 1).
Des peptides qui diffèrent par une seule charge sont facilement séparés
par cette méthode. De plus, la séparation des peptides de charges
égales (par ex. la bradykinine d’Ile-Ser et la bradykinine intégrale)
illustre la capacité à séparer les peptides présentant
seulement de légères différences d’hydrophobicité.
Un exemple d’utilisation de la chromatographie d’échange
ionique pour le traçage des peptides est montré en figure 2.
Les pics nombreux présentent une bonne résolution avec une excellente
symétrie des pics. La digestion tryptique de cytochrome c employant
les conditions de digestion décrites produit typiquement entre 15-20
peptides. Plusieurs de ces peptides sont cationiques avec les points isoélectriques
semblables. D’autres colonnes d’échange ionique présentent
souvent une résolution incomplète de ces peptides sans séparation
à la ligne de base. Ces chromatogrammes démontrent la capacité
de la Luna SCX à séparer différents mélanges de
peptides.
Références
1. F. Regnier and R. Chicz in HPLC of Biological Macromolecules
K.Gooding and F. Regneir (Ed.) pg. 77-93 (1990) Marcel Dekker
2. M.Ronk et. al. in Techniques in Protein Chemistry V J.Crabb
(Ed.) pg.259-268 (1994) Academic Press