Par Sino Biological Europe GmbH - www.sinobiological.com
Les inhibiteurs de points de contrôle immunitaire (ICI) représentent une avancée significative dans le traitement des cancers. Le développement continu de nouveaux ICIs ainsi que la découverte de biomarqueurs ont considérablement amélioré l’efficacité thérapeutique de ces agents.
Introduction
Le cancer est l'un des problèmes de santé les plus préoccupants au niveau mondial, et sa prévalence ne cesse d'augmenter depuis des années. L’immunothérapie anticancéreuse s’est récemment imposée en tant qu’approche hautement efficace dans la lutte contre le cancer [1]. Contrairement aux traitements conventionnels, l’immunothérapie exploite le système immunitaire du corps pour prévenir, gérer et éliminer le cancer [2]. Des années de recherche et développement ont permis de mettre au point des méthodes d’immunothérapie anticancéreuse remarquables, notamment des ICIs, des vaccins contre le cancer, la virothérapie oncolytique, le remodelage du microenvironnement tumoral (TME), des anticorps ciblés et le transfert adoptif de cellules [3].
Les points de contrôle immunitaire sont des signaux de co-stimulation et d’inhibition permettant la régulation de la reconnaissance des antigènes par les récepteurs des lymphocytes T (TCR) dans le processus de réponse immunitaire. Ils peuvent empêcher le système nerveux de réagir de manière excessive et maintenir l’homéostasie immunitaire pendant les réponses immunitaires antimicrobiennes ou antivirales. Toutefois, les cellules cancéreuses sont capables d’imiter les ligands des points de contrôle immunitaire pour échapper au système de surveillance immunitaire [4]. L’utilisation des ICIs peut perturber l’interaction entre les points de contrôle immunitaire et leurs ligandsen levant la suppression de la fonction immunitaire et réactivant les cellules immunitaires, leur permettant par conséquent d’induire des effets antitumoraux [5]. Dans cet article, nous vous proposons un aperçu de la manière dont les ICIs sont utilisés dans le traitement des cancers.
ICIs approuvés par la FDA
En 2011, l’inhibiteur de CTLA-4 l’ipilimumaba été le premier ICI approuvé par la FDA pour le traitement des cancers. Par la suite, plusieurs essais cliniques ont démontré les effets antitumoraux considérables des inhibiteurs de PD-1/PD-L1 qui ont été approuvés pour le traitement de diverses tumeurs malignes comprenant les mélanomes, les carcinomes pulmonaires non à petites cellules et les carcinomes à cellules rénales [6].
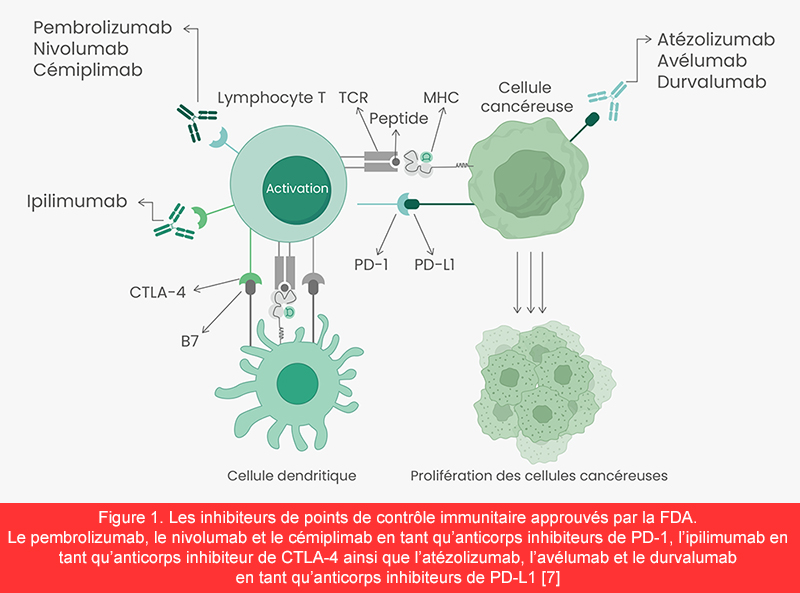
Le CTLA-4 est largement exprimé sur les lymphocytes T activés et sert à mettre fin aux réponses immunitaires par l’intermédiaire de son interaction avec ses récepteurs antigéniques. Les inhibiteurs de CTLA-4 stimulent l’activation et la prolifération des lymphocytes T, ce qui entraîne la destruction des cellules tumorales (figure 1) [7]. Le PD-1 est un récepteur inhibiteur que l’on trouve sur les lymphocytes T activés, les cellules tueuses naturelles (NK) et les monocytes. Le ligand 1 de PD-1 (PD-L1) est une protéine transmembranaire exprimée sur la surface des cellules tumorales. L’interaction entre PD-L1 et PD-1 inhibe la migration et la prolifération des lymphocytes T, ce qui permet aux cellules tumorales d’échapper plus facilement au système immunitaire. Les inhibiteurs de PD-1/PD-L1 bloquent la liaison entre PD-1 et PD-L1, réactivent ainsi les réponses des lymphocytes T à l’encontre des tumeurs et suscitent des effets antitumoraux [8]. La FDA a approuvé l’utilisation de trois anticorps monoclonaux en tant qu’inhibiteurs de PD-1 : le nivolumab, le pembrolizumab et le cémiplimab. Egalement, trois inhibiteurs de PD-L1, l’atézolizumab, le durvalumab et l’avélumab ont été approuvés pour le traitement de plusieurs types de tumeurs solides tels que les CPNPC, les CETC, les mélanomes et les CM (figure 1).
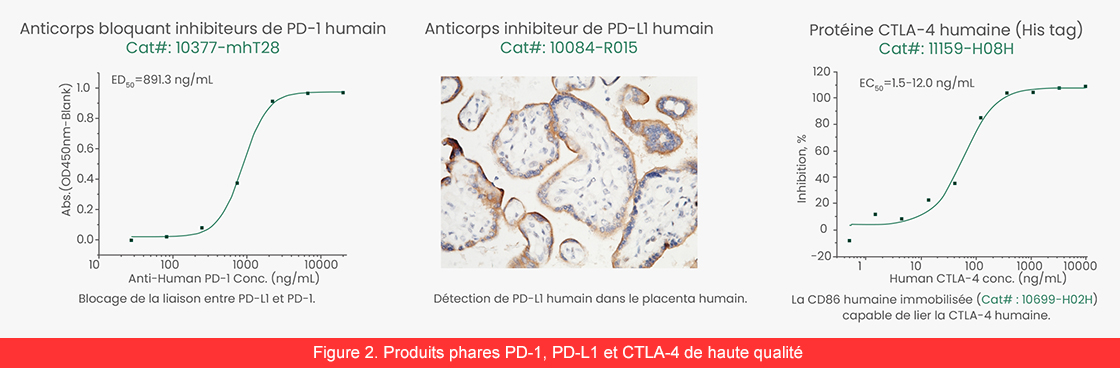
Afin de soutenir la recherche sur les traitements combinés, Sino Biological a mis au point une gamme d’anticorps bloquants, d’anticorps neutralisants, de protéines, de kits ELISA et d’autres produits de haute qualité (figure 2). Veuillez cliquer ici pour afficher plus de produits destinés à la recherche sur les points de contrôle immunitaire.
Nouveaux ICIs
Au cours des dernières années, des progrès rapides ont été observés dans le développement et l’approbation des ICIs pour le traitement de divers types de cancers. Bien que les inhibiteurs de CTLA-4 et de PD-1/PD-L1 aient fait preuve d’une efficacité considérable, l’efficacité thérapeutique globale des ICIs reste limitée en raison de la nature complexe du microenvironnement tumoral et de la diversité des caractéristiques des tumeurs. En outre, certains traitements à base d’ICI sont associés à des effets indésirables. Afin d’améliorer l’efficacité de l’immunothérapie, un grand nombre de nouveaux points de contrôle immunitaire font constamment l’objet de développements, Notamment VISTA, TIM-3, LAG-3, CD47, IDO-1, CD96, B7-H3, TIGIT, CD155, etc.
TIGIT
La protéine TIGIT, un membre de la superfamille des immunoglobulines, est principalement exprimée à la surface des cellules NK, CD8+ T, CD4+ T et cellules T régulatrices (Treg). Elle comporte trois ligands : CD155, CD112 et CD113. Sur le plan structurel, TIGIT comprend un domaine extracellulaire variable de l’immunoglobuline (Ig), un domaine transmembranaire de type 1 et une queue cytoplasmique avec deux motifs d’activation de récepteurs inhibitifs : un motif ITIM et un motif Ig analogue à la queue de la tyrosine. Les inhibiteurs de la TIGIT ont démontré leur potentiel d’amélioration des effets antitumoraux, principalement lorsqu’ils sont utilisés conjointement avec les inhibiteurs de PD-1/PD-L1.
VISTA
VISTA est un gène codant pour une protéine qui présente une certaine similarité avec PD-L1 et PD-L2. Il est fortement exprimé dans les cellules myéloïdes suppressives et les cellules immunitaires. En outre, le VISTA présente des niveaux d’expression élevés dans une gamme de types de cancers humains, comme les cancers du poumon, du rein et colorectal. VISIG-3 est un ligand de la protéine VISTA et agit comme inhibiteur de la production des cytokines et des chimiokines.
CD47
La CD47 est une protéine surexprimée dans diverses cellules tumorales solides et hématologiques. Elle joue un rôle essentiel dans la modulation de l’immunité en interagissant avec la protéine régulatrice de signal α (SIRPα), ce qui empêche efficacement les macrophages d’éliminer les cellules tumorales. Actuellement, la recherche et le développement de médicaments anti-CD47 se concentrent principalement sur trois aspects : les médicaments ciblant la CD47, la SIRP α et la protéine de fusion SIRPα-Fc de la molécule CD47 dans les cellules tumorales.
TIM-3
La TIM-3 est une protéine transmembranaire codée par HAVCR2 et largement exprimée dans diverses cellules immunitaires. La TIM-3 interagit avec quatre ligands spécifiques qui sont la galectine-9, la molécule d’adhésion cellulaire 1 de l’antigène carcinoembryonnaire (Ceacam-1), le HMGB1 et la phosphatidylsérine (PtdSer). Au départ, la TIM-3 avait été identifiée en tant que récepteur exprimé sur les cellules Th1 CD4+ productrices d’IFN-γ et les cellules T CD8+ cytotoxiques 1 (Tc1). Des études récentes ont montré qu’elle possède des capacités d’évasion du système immunitaire à l’instar de PD-1 et de CTLA-4. Bien que de nombreuses études précliniques et cliniques aient mis en évidence la TIM-3 comme un point de contrôle immunitaire prometteur, sa large expression dans divers types de cellules suscite des inquiétudes quant aux effets indésirables graves potentiels associés à l’utilisation systémique d’anticorps. Par conséquent, il est indispensable de développer des médicaments à base d’anticorps capables de cibler la TIM-3 de manière sélective.
Produits vedettes
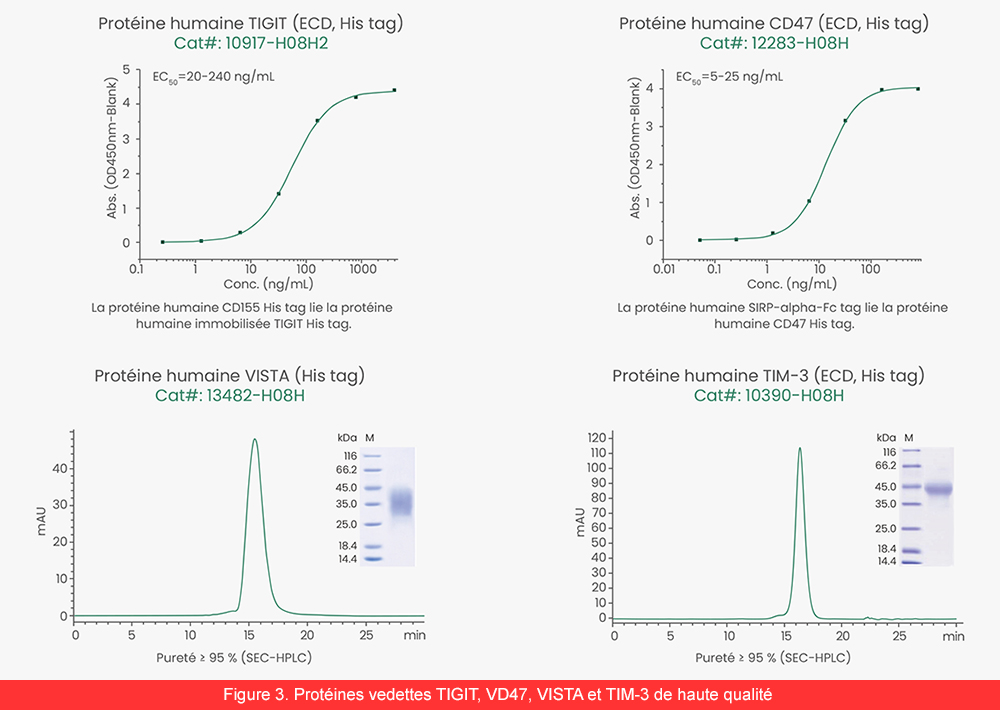
Afin de soutenir la recherche dans le domaine des ICIs, Sino Biological propose des protéines de point de contrôle immunitaire de haute qualité, d’une haute pureté, avec une bio activité validée. Nous couvrons une large gamme d’espèces et de tags (figure 3) ainsi que des protéines cytokines, des kits et anticorps ELISA pour les tests fonctionnels sur cellules.
Traitement combiné à base d’ICIs
Actuellement, l’utilisation conjointe de plusieurs ICIs est un axe de recherche important dans le domaine de l’immunothérapie anticancéreuse. Le traitement à base d’ICIs combiné au ciblage de précision et de plusieurs voies, présente des avantages uniques lorsqu’il s’agit de surmonter la résistance aux médicaments ainsi que d’améliorer la reconnaissance et l’élimination de cellules tumorales spécifiques par les cellules immunitaires. Par exemple, il a été démontré que la combinaison d’un inhibiteur de PD-1 avec un inhibiteur de CTLA-4 présente l’avantage de prolonger la survie des patients atteints d’un cancer du poumon. La combinaison des inhibiteurs de PD-1 et de TIM-3 dans le traitement du CPNPC permet de contrer la résistance aux inhibiteurs de PD-1. De même, la combinaison d’un inhibiteur de CTLA-4 avec un inhibiteur de LAG-3 peut induire une tolérance immunitaire grâce à la co-suppression des voies de signalisation [9].
Biomarqueurs prédictifs pour les ICIs
Le traitement du cancer avec des thérapies anti-points de contrôle immunitaire est souvent entravé par un faible taux de réponse et des effets indésirables liés au système immunitaire chez certains patients atteints de cancer. Il est par conséquent indispensable de développer des ensembles de biomarqueurs capables de prédire la réponse au blocage des points de contrôle immunitaire et les effets indésirables liés au système immunitaire. Les biomarqueurs prédictifs peuvent fournir des indications sur le devenir d'un patient avant le traitement, ce qui orienterait la décision d'utilisation d'une monothérapie ou une thérapie combinée. Cette approche permet une immunothérapie précise et adaptée à chaque patient. Actuellement, les biomarqueurs PD-L1 et dMMR/MSI-H sont approuvés pour l’indication clinique de l’efficacité des inhibiteurs de PD-1/PD-L1. Davantage de preuves issues d’études cliniques sont nécessaires pour l’approbation d’autres biomarqueurs prédictifs potentiels [10].
Résumé
L’avènement de l’immunothérapie antitumorale a conduit à des changements importants dans le traitement des cancers. Les ICIs bien connus tels que les inhibiteurs de CTLA-4 et de PD-1/PD-L1 ainsi que les nouveaux ICIs tels que les inhibiteurs de VISTA, CD47, TIGIT et TIM-3, entre autres, sont à présent largement utilisés dans le traitement de nombreux types de cancers comme les mélanomes, les cancers du poumon non à petites cellules, le cancer avancé du col de l’utérus et les carcinomes hépatocellulaires. En plus de l’utilisation d’ICIs seuls, un nombre croissant d’études cliniques explorent les immunothérapies combinées, y compris la combinaison de différents ICIs et l’association des ICIs avec la radiothérapie, la chimiothérapie et la thérapie ciblée. Néanmois, il est essentiel de noter que les biomarqueurs actuellement utilisés pour prédire l'efficacité de l'immunothérapie des tumeurs, tels que les niveaux d'expression du PD-L1, le TMB et le MSI-H, ont des limites pour prédire avec précision l'efficacité des ICIs et les résultats thérapeutiques. Il est donc urgent de découvrir des biomarqueurs prédictifs plus précis pour une meilleure efficacité des ICIs dans l'avenir.
Références:
[1] Liu C, Yang M, Zhang D, Chen M, Zhu D. Clinical cancer immunotherapy: Current progress and prospects. Front Immunol. doi:10.3389/fimmu.2022.961805
[2] Peterson C, Denlinger N, Yang Y. Recent Advances and Challenges in Cancer Immunotherapy. Cancers (Basel). 2022;14(16):3972. doi:10.3390/cancers14163972
[3] Meng X, Lei Y, Zhang X, et al. Cancer immunotherapy: Classification, therapeutic mechanisms, and nanomaterial-based synergistic therapy. Applied Materials Today, 2021, 24: 101149. doi: 10.1016/j.apmt.2021.101149
[4] Cai X, Zhan H, Ye Y, et al. Current Progress and Future Perspectives of Immune Checkpoint in Cancer and Infectious Diseases. Front Genet. 2021;12:785153. doi:10.3389/fgene.2021.785153
[5] Johnson DB, Nebhan CA, Moslehi JJ, Balko JM. Immune-checkpoint inhibitors: long-term implications of toxicity. Nat Rev Clin Oncol. 2022;19(4):254-267. doi:10.1038/s41571-022-00600-w
[6] Naimi A, Mohammed RN, Raji A, et al. Tumor immunotherapies by immune checkpoint inhibitors (ICIs); the pros and cons. Cell Commun Signal. 2022;20(1):44. doi:10.1186/s12964-022-00854-y
[7] Shiravand Y, Khodadadi F, Kashani S M A, et al. Immune checkpoint inhibitors in cancer therapy. Current Oncology, 2022, 29(5): 3044-3060. doi:10.3390/curroncol29050247
[8] Han Y, Liu D, Li L. PD-1/PD-L1 pathway: current researches in cancer. Am J Cancer Res. 2020;10(3):727-742.
[9] Vafaei S, Zekiy AO, Khanamir RA, et al. Combination therapy with immune checkpoint inhibitors (ICIs); a new frontier. Cancer Cell Int. 2022;22(1):2. doi:10.1186/s12935-021-02407-8
[10] Darvin P, Toor SM, Sasidharan Nair V, Elkord E. Immune checkpoint inhibitors: recent progress and potential biomarkers. Exp Mol Med. 2018;50(12):1-11. doi:10.1038/s12276-018-0191-1