Le minicircle est apparu comme un vecteur génique de nouvelle génération et un outil prometteur dans le domaine de l’administration de gènes et des applications thérapeutiques. Cet article vise à fournir un aperçu des caractéristiques, des méthodes de production et des applications potentielles de l’ADN minicircle.
Introduction
La thérapie génique est très prometteuse pour le traitement de divers troubles et maladies génétiques. Cependant, le succès de la thérapie génique dépend en grande partie de l’administration efficace et sûre des gènes thérapeutiques dans les cellules cibles. Les vecteurs traditionnels d’administration de gènes non viraux, tels que l’ADN plasmidique, souffrent souvent de limitations telles que l’immunogénicité, la capacité de charge limitée et l’intégration potentielle dans le génome hôte, ainsi que le fait de porter des motifs géniques indésirables, tels que les gènes de résistance aux antibiotiques.
Les minicircles sont une approche prometteuse pour surmonter les inconvénients de l’ADN plasmidique. Ce sont des molécules d’ADN double brin circulaires surenroulées qui n’ont pas de séquences de squelette bactérien, ce qui entraîne une taille plus petite par rapport à l’ADN plasmidique conventionnel. Comme les plasmides, ils peuvent être conçus pour contenir des éléments régulateurs particuliers, tels que des promoteurs ou des amplificateurs spécifiques aux tissus, afin d’améliorer l’expression génique dans les types de cellules souhaités. Les minicircles sont structurellement identiques aux plasmides car ils sont fermés par covalence (ccc – covalent closed circular) surenroulés, ce qui entraîne une topologie extrêmement petite, mais en même temps, très efficace. Cependant, la taille nettement plus petite permet d’augmenter la capacité de charge, d’améliorer la stabilité et de réduire l’immunogénicité.
Production de minicircles
PlasmidFactory utilise une technologie brevetée exclusive pour produire de l’ADN minicircle non synthétique. Un plasmide contenant le gène d’intérêt (GdI) sert de matériau de départ. Le GdI est inséré dans le plasmide dit parental, suivi d’une recombinaison intramoléculaire. L’ADN minicircle qui en résulte contient presque exclusivement le GdI et ses motifs de séquence de régulation, ainsi qu’une région de séquence courte pour la purification par affinité (SCAR – région amplifiée à séquence connue). Les séquences de squelette bactérien superflues sont totalement éliminées.
Cette technologie minicircle exclusive est brevetée dans le monde entier et disponible exclusivement chez PlasmidFactory.
ADN minicircle vs plasmidique
Lors de la comparaison d’un minicircle avec le plasmide conventionnel correspondant, portant la même cassette génique, par exemple, le gène rapporteur GFP, les minicircles montrent une expression génique améliorée dans toutes les lignées cellulaires testées. Cette amélioration est non seulement médiée par une augmentation du nombre de copies d’ADN intracellulaire après le transfert de gènes à l’aide de minicircles, mais également par un nombre plus élevé de cellules positives pour le GFP après le transfert de gènes dans les minicircles, comme le révèle l’analyse FACS (tri cellulaire activé par fluorescence). Au total, ces taux de transfert de gènes améliorés après transfection avec l’ADN minicircle conduisent à une transcription accrue de l’ARNm transgénique par rapport aux résultats obtenus avec l’ADN plasmidique conventionnel.
Les minicircles portant d’autres gènes rapporteurs tels que la luciférase et le lacZ ont été produits avec succès avec un rendement élevé et une qualité reproductible. Ils ont déjà été utilisés pour le transfert de gènes, par exemple, par lipofection ou électroporation dans diverses lignées cellulaires de mammifères [1,2].
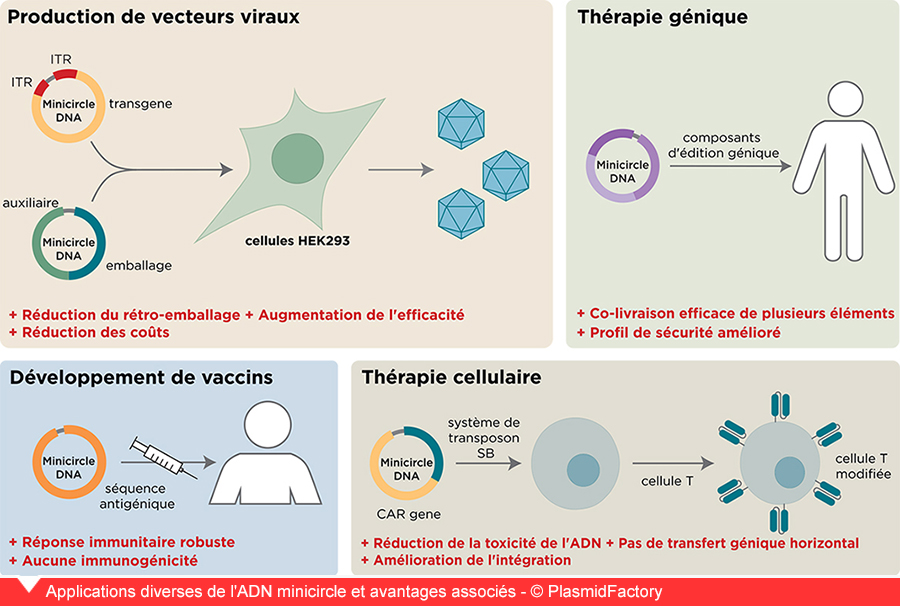
Applications de l’ADN minicircle
1. Thérapie génique et édition génique : l’édition génique in vivo nécessite souvent plusieurs éléments d’édition. La capacité de charge accrue des minicircles permet la co-distribution de plusieurs composants, améliorant l’efficacité et la polyvalence des approches d’édition génique. Par exemple, l’administration d’éléments CRISPR-Cas9 basée sur des minicircles permet des modifications précises du génome cible pour moduler des processus cellulaires spécifiques et présente en général un grand potentiel pour d’autres applications de thérapie génique, en raison de son profil de sécurité amélioré et de sa capacité de charge accrue.
2. Développement de vaccins : la capacité à concevoir des minicircles avec des séquences antigéniques spécifiques et des éléments immunomodulateurs en fait une plateforme attrayante pour le développement de vaccins. Ces vaccins à base de minicircles se sont révélés prometteurs pour induire des réponses immunitaires robustes contre les maladies infectieuses et le cancer [3].
3. Production de vecteurs viraux : AAV
Dans la production de vecteurs AAV (virus adéno-associé), les plasmides sont souvent utilisés comme matériaux de départ. Ces plasmides contiennent des informations sur l’emballage des gènes thérapeutiques dans les particules virales. Cependant, les gènes de résistance bactérienne contenus dans les plasmides peuvent également être transférés dans la capside AAV. Ledit rétro-emballage peut entraîner une contamination et nuire à l’application thérapeutique.
Des chercheurs de PlasmidFactory, de l’Université médicale de Hanovre (MHH), du Centre de médecine moléculaire de Cologne (ZMMK) et du laboratoire Kornea de l’Université d’Erlangen ont mis en place un flux de travail innovant basé sur l’ADN minicircle. L’utilisation du vecteur d’ADN minimaliste à la place des plasmides conventionnels évite le rétro-emballage des séquences bactériennes et améliore considérablement la pureté et la qualité des vecteurs viraux.
De plus, cette stratégie permet la production de vecteurs AAV sans gènes de résistance bactérienne et répond donc déjà aux futures exigences réglementaires pour les vecteurs viraux utilisables à des fins thérapeutiques.
L’ADN minicircle offre ainsi une alternative prometteuse pour la production d’AAV [4].
4. Thérapies cellulaires : cellules CAR-T
Le domaine de l’oncologie a connu une expansion des immunothérapies avec l’introduction des thérapies par lymphocytes T CAR (récepteur de l’antigène chimérique). Ces thérapies ciblent les antigènes exprimés sur les cellules tumorales dont les lymphocytes T modifiés par CAR les reconnaissent et les détruisent. Cependant, les méthodes de fabrication actuelles utilisant la transfection de plasmides ont une faible efficacité en raison d’une certaine toxicité de l’ADN, tandis que la transfection à base de vecteurs viraux présente des risques pour la sécurité et des défis réglementaires. Les faibles taux de transfert de gènes et la toxicité élevée des lymphocytes T nécessitent souvent des cycles d’expansion répétés pour maintenir les lymphocytes T modifiés, ce qui prend du temps, coûte cher et peut entraîner un épuisement des lymphocytes T.
L’ADN minicircle montre une toxicité et une immunogénicité de l’ADN considérablement réduites, ce qui rend la production de cellules CAR-T beaucoup plus efficace. En combinaison avec le système de transposon Sleeping Beauty, il permet le transfert de gènes non viraux avec un profil d’intégration quasi-aléatoire. Cela améliore considérablement le profil de sécurité des cellules CAR-T résultantes ![5,6]. Cela est également vrai pour la reprogrammation de cellules souches comparativement sensibles [7].
Conclusion et perspectives
Dans l’ensemble, l’ADN minicircle offre plusieurs avantages par rapport aux plasmides traditionnels et surmonte les lacunes actuelles dans le domaine de la thérapie génique et cellulaire.
La petite taille et l’immunogénicité réduite ne sont que deux exemples qui, à leur tour, sont associés à d’autres avantages. Avec ces caractéristiques uniques, il combine sécurité, efficacité et conformité réglementaire, ce qui en fait une alternative attrayante aux vecteurs traditionnels d’administration de gènes et un outil indispensable pour faire progresser les thérapies géniques et la médecine personnalisée.
PlasmidFactory étend actuellement ses capacités de production d’ADN minicircle et se prépare en outre à la fabrication, conformément aux directives des Bonnes pratiques de fabrication (BPF) en construisant la première installation BPF au monde, spécialement équipée pour la production (à grande échelle) d’ADN minicircle ! L’ADN minicircle produit dans cette installation répondra aux exigences strictes des produits thérapeutiques à usage humain.
La recherche et le développement futurs élargiront davantage le domaine d’application de l’ADN minicircle et exploreront son plein potentiel pour une utilisation thérapeutique.
Références principales :
[1] D. Kolbelt, M. Schleef, M. Schmeer, J. Aumann, P.M. Schlag,W. Walther (2013), Performance of High Quality Minicircle DNA for In Vitro and In Vivo Gene Transfer, Mol. Biotechnol., 53 (1), 80-89.
[2] S. Chabot, J. Orio, M. Schmeer, M. Schleef, M. Golzio, J. Teissié (2013), Minicircle DNA Electrotransfer for efficient Tissue targeted Gene Delivery, Gene Therapy 20 (1), 62-68
[3] M. Schleef, R. Schirmbeck, M. Reiser, M.L.Michel, M. Schmeer (2015). Minicircle: Next Generation DNA Vectors for Vaccination. In: Walther, W., Stein, U. (eds) Gene Therapy of Solid Cancers. Methods in Molecular Biology, vol 1317. Humana Press, New York, NY. https://doi.org/10.1007/978-1-4939-2727-2_18
[4] M. Schnödt, M. Schmeer, B. Kracher, C. Krüsemann, L. E. Espinosa, A. Grünert, T. Fuchsluger, A. Rischmüller, M. Schleef and H. Büning (2016), DNA Minicircle Technology Improves Purity of Adeno-associated Viral Vector Preparations, Molecular Therapy—Nucleic Acids, 5, e355.
[5] R. Monjezi, C. Miskey, T. Gogishvili, M. Schleef, M. Schmeer, H. Einsele, Z. Ivics and M. Hudecek (2016), Enhanced CAR T-cell engineering using non-viral Sleeping Beauty transposition from minicircle vectors, Leukemia, 1-9.
[6] D. Lock , R. Monjezi, C. Brandes , S. Bates, S. Lennartz, K. Teppert , L. Gehrke, R. Karasakalidou-Seidt, T. Lukic, M. Schmeer, M. Schleef, N. Werchau, M. Eyrich , M. Assenmacher, A. Kaiser, S. Prommersberger, T. Schaser, M. Hudecek, Automated, scaled, transposon-based production of CAR T cells, open access, Journal for Immuno Therapy of Cancer (2022)
[7] M. Holstein, C. Mesa-Nuñez, C. Miskey et al. (2018), Efficient Non-viral Gene Delivery into Human Hematopoietic Stem Cells by Minicircle Sleeping Beauty Transposon Vectors, Molecular Therapy Vol. 26 No 4, 1137-1153, April 2018
Contact :
PlasmidFactory GmbH
info@plasmidfactory.com - www.PlasmidFactory.com