Vers un nouveau standard de référence pour le traitement des plaques !
Introduction
Les plaques PCR et les microplaques nécessitent généralement un type de scellage pour prévenir l'évaporation, ce qui pourrait, autrement, altérer la concentration des échantillons et compromettre la reproductibilité.
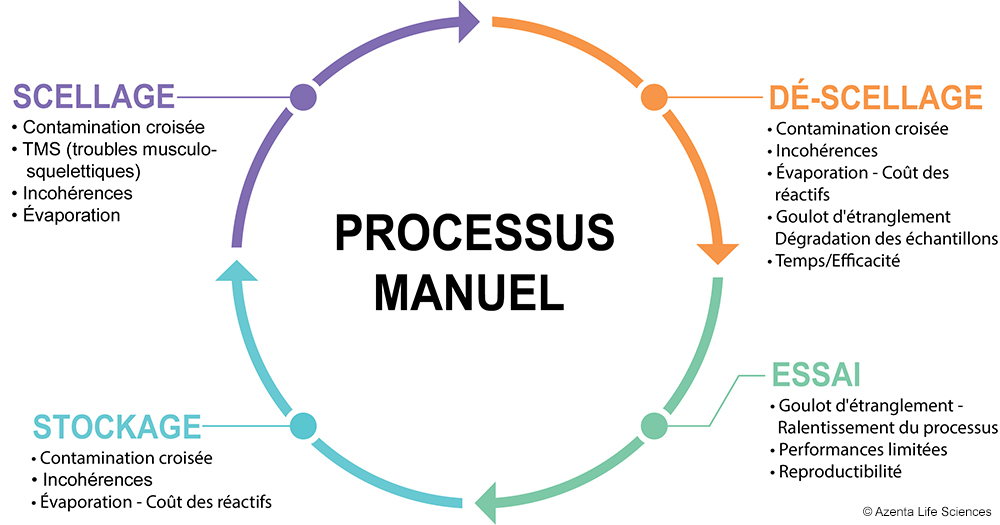
Le scellage et le déscellement manuels des plaques peuvent constituer un processus à faible coût pour les laboratoires et les flux de travail à faible débit. Cependant, à mesure que la quantité de plaques à manipuler augmente, les risques de dangers et de contraintes associés augmentent également. Ceux-ci peuvent inclure :
Trouble musculo–squelettique répétitif
Les périodes d’arrêt dues aux absences peuvent avoir un impact direct sur le rendement du laboratoire et potentiellement accroître la charge de travail déjà élevée. Une cause fréquente de jours de travail perdus est le syndrome du canal carpien (SCC), dont l'incidence a augmenté de 500% au cours des deux dernières décennies, entraînant plus de jours d’absence que toute autre blessure professionnelle. Les conditions de travail et le type de tâches effectuées ont été établis comme étant des facteurs plus déterminants que les caractéristiques physiques, dans la gravité de la neurocompression. Autrement dit, le retour au travail est davantage influencé par les conditions de travail que par des facteurs cliniques ou des caractéristiques physiques.
L'utilisation des mains dans un cadre professionnel est considérée comme un facteur de risque ergonomique et comprend les mouvements de poignet très répétitifs et une forte force de pincement, comme lors du scellage et du décollement des plaques. La répétition est le facteur de risque le plus reconnu et est définie par la fréquence de la tâche ou la proportion du temps passé à effectuer un travail répétitif.
Des études épidémiologiques ont également considéré qu'une force de prise élevée des mains/doigts était un cofacteur de risque pour le SCC, en fonction du poids de l'outil utilisé ou de l'impact.
Contamination croisée & évaporation
Peu importe le niveau de formation ou d'attention, des erreurs humaines peuvent survenir, ou du moins induire un certain niveau d'incohérence. En ce qui concerne le scellage manuel, les dangers peuvent provenir de plusieurs sources, notamment :
Manque d’uniformité du scellage sur la plaque – Si une pression uniforme n'est pas appliquée à un scellé adhésif avec la force appropriée, cela peut entraîner des puits mal scellés ou non scellés, ce qui peut provoquer l'évaporation de réactifs coûteux ou même le transfert d'échantillons d'un puits à un autre.
Sur-scellage des puits – Dans le cas où une force excessive a été exercée sur le scellage, cela peut engendrer des problèmes lors du décollement en aval.
Méthodes de thermoscellage non testées – L’utilisation de solutions « faites maison » peut engendrer des incohérences et des variations de température ou de timing de scellage, produisant ainsi des scellages défectueux, hétérogènes ou insuffisamment étanches. Cela peut également favoriser la contamination croisée entre les échantillons des différents puits, voire l'évaporation de ces derniers ainsi que des réactifs.
Les méthodes de décollement manuel peuvent être tout aussi risquées et présenter des dangers tels que :
Mauvaise manipulation accidentelle – Une contamination croisée peut survenir en raison d'une mauvaise manipulation des plaques lors du décollement si la plaque ou le scellé glisse, les échantillons peuvent migrer d'un puits à un autre, rendant la plaque inutilisable.
Ruissellement d'échantillon – Selon l'angle de retrait du scellé, des échantillons adhérant à la face inférieure du scellé peuvent, par tension de surface, s'écouler le long du scellé et contaminer un autre puits.
Perte de temps due aux goulets d’étranglement
Dans de nombreux laboratoires, le dé-scellage/re-scellage manuel peut représenter plusieurs centaines d'heures de travail précieuses en seulement quelques semaines d'exploitation. Dans toute organisation où une productivité élevée est essentielle — par exemple, dans une opération compétitive de découverte de médicaments — les contretemps dus à ce goulot d'étranglement peuvent entraîner des retards significatifs dans les objectifs du laboratoire, voire dans les plans globaux de l'entreprise.
De plus, le retrait manuel des scellés entraîne souvent une mauvaise allocation des ressources humaines, tandis qu’une automatisation coûteuse reste sous-exploitée. Le temps imparti au dé-scellage/re-scellage manuel des plaques empêche ainsi les techniciens de se consacrer à des projets scientifiques à plus forte valeur ajoutée.
Coût
L'évaporation des réactifs et de la perte d'échantillons peuvent avoir un impact considérable lors d'expériences à haut débit. De plus que la contamination croisée des plaques due à une erreur humaine affecte directement les ressources du laboratoire. Ces deux problèmes nécessitent la répétition des essais et entraînent une augmentation du coût total des réactifs.
Spécifications des installations
Lors du choix d'un équipement de scellage/dé-scellage de plaques, il est essentiel de prendre en compte les spécifications de votre laboratoire. Par exemple, certains modèles de scelleuses de plaques nécessitent une alimentation en air externe. Adapter les laboratoires existants pour y intégrer une alimentation en air externe peut s’avérer coûteux, notamment en raison des temps d'arrêt.
Une fois installée, la scelleuse de plaques est généralement fixe et difficile à déplacer, à moins que l'alimentation en air externe ne soit également repensée. La hauteur du banc ou du plateau peut également constituer un facteur limitant — de nombreuses plateformes d'automatisation ayant des hauteurs de plateau basses, restreignant ainsi les options d'installation.
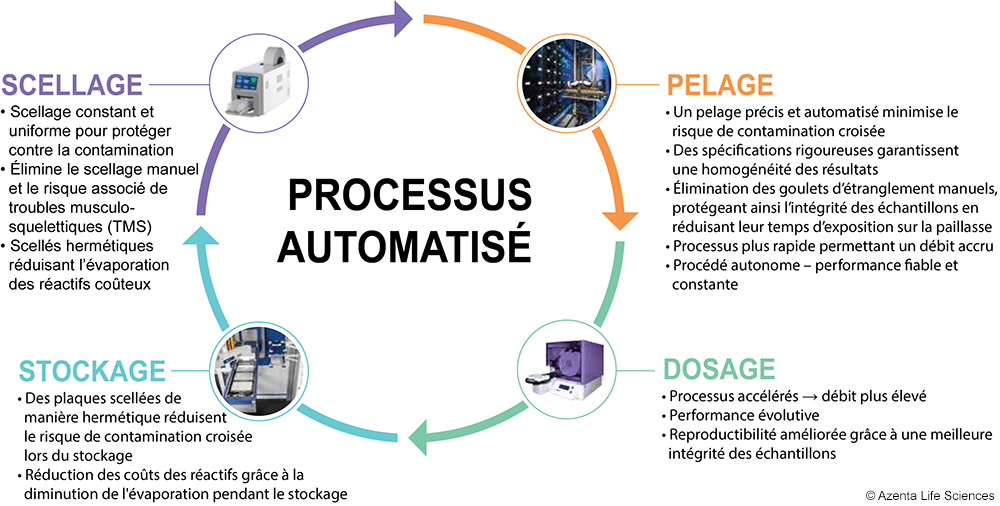
L’automatisation pour surmonter les dangers du scellage et du pelage manuels des plaques
Afin d’optimiser la qualité de scellage et de pelage, il est essentiel d’identifier et d’analyser les défis existants. L’automatisation joue un rôle clé dans la réduction des risques associés aux dangers et aux contraintes décrits dans cette infographie. Azenta Life Sciences propose une solution qui combine le scelleur thermique automatique à rouleau et un détacheur automatique de scellage de plaque, pour vous permettre de résoudre plusieurs problématiques– allant de la contamination croisée aux exigences des infrastructures, comme en témoigne le Dr Vlad Zarayskiy, scientifique principal, dans l’étude de cas liée à ce document.
Troubles musculo-squelettiques (TMS)
La réduction des étapes mécaniques requises par les techniciens, en éliminant la nécessité d'ajouter et de retirer manuellement les scellés des plaques, réduit significativement le risque de troubles musculo-squelettiques (TMS). Par exemple, le scelleur thermique automatique à rouleau peut réaliser jusqu'à 5 000 scellements sans intervention manuelle.
Contamination croisée & évaporation
L'automatisation assure un contrôle qualité optimal grâce à un scellage homogène et sécurisé des plaques, minimisant ainsi l'évaporation des réactifs précieux et le risque de contamination croisée. De plus, un pelage précis et automatisé, grâce au détacheur automatique de scellage de plaque, réduit davantage le risque de contamination croisée due au ruissellement des échantillons.
Perte de temps due aux goulets d’étranglement
L'automatisation des étapes de scellage et de pelage des plaques accélère le traitement améliorant ainsi le débit des laboratoires tout en libérant du temps pour les scientifiques. L’intégration dans des flux de travail robotiques améliore encore davantage le processus, offrant une solution ergonomique et autonome.
Coût
Le scellage thermique automatisé des plaques permet de réduire les coûts par rapport à d'autres méthodes telles que les bouchons ou les scellés adhésifs. De plus, la préservation accrue de l'intégrité des échantillons, grâce à la réduction de la contamination croisée et de l'évaporation, permet d'économiser des échantillons et réactifs précieux.
Spécifications des installations
Ne nécessitant pas d’air comprimé, le scelleur thermique automatique à rouleau peut être installé rapidement et offre une grande flexibilité. Il peut être facilement déplacé dans le laboratoire, que ce soit en tant qu’unité autonome sur paillasse ou intégré à un système robotisé, sans contrainte liée à un apport d’air.
Pour en savoir plus :
Azenta Life Sciences
www.azenta.com/consumables-instruments
Références
1. Kao, YS. (2003) “Carpel Tunnel Syndrome As an Occupational Disease”, JABFP, 16, (6), pp 533-542.
2. Moore, JS., Garg, A. (1994) “Upper extremity disorders is a pork processing plant...”
3. De Kesel, R., Donceel, P., De Smet, L. (2008). “Factors influencing return to work after surgical treatment for carpel tunnel syndrome”
4. Shiri, R., Miranda, H., Heliovaara, M., Viikari-Juntura, E. (2009), “Physical work load factors and carpel tunnel syndrome”
5. The Transformative Benefits of Automation in High Throughput Drug Discovery Workflows. Azenta Life Sciences White Paper (2019).