Par SINO BIOLOGICAL - www.sinobiological.com
Les maladies auto-immunes résultent des mécanismes complexes de la dysrégulation immunitaire, caractérisée par une autotolérance diminuée et une inflammation chronique. Au cœur de ces processus se trouvent les cytokines, des protéines de signalisation solubles qui organisent les réponses immunitaires en assurant la communication entre les cellules. Les réseaux de cytokines présentent une double fonctionnalité : elles sont des régulateurs essentiels de l’homéostasie immunitaire, mais agissent aussi, paradoxalement, comme des agents pathogènes dans les maladies telles que la polyarthrite rhumatoïde (PR), le lupus érythémateux systémique (LES), le psoriasis et les myopathies inflammatoires. Les recherches ont démontré le fort potentiel thérapeutique des produits biologiques ciblant les cytokines, des inhibiteurs de Janus kinase (JAK) et des stratégies émergentes, telles que la modulation des micro-ARN et les cytokines modifiées.
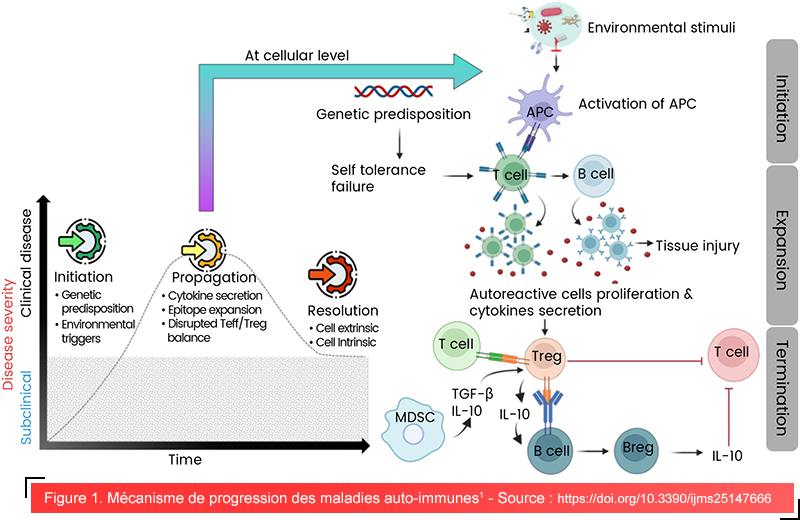
Mécanisme de l’auto-immunité
L’auto-immunité résulte de perturbations complexes des voies de signalisation immunitaire, dans lesquelles la prédisposition génétique et les facteurs environnementaux déclenchent l’activation des lymphocytes autoréactifs, la production excessive de cytokines et la libération d’auto-anticorps dont l’action conjointe endommage les tissus sains. La résolution des processus auto-immuns, lorsqu’elle est possible, dépend de la restauration des mécanismes de régulation par les lymphocytes T régulateurs (Treg) et les lymphocytes B régulateurs (Breg), qui produisent des cytokines immunosuppressives telles que le facteur de croissance transformant bêta (TGF-β) et l’interleukine-10 (IL-10), qui contribuent à la réparation des lésions tissulaires et à la suppression des voies inflammatoires activées pendant les phases d’initiation et de propagation.
Les réseaux des cytokines dans les maladies auto-immunes
Dominance des cytokines pro-inflammatoires
La pathogenèse des maladies auto-immunes est souvent favorisée par un environnement caractérisé par une hyperactivité des cytokines pro-inflammatoires. Le facteur de nécrose tumorale-alpha (TNF-α), l’IL-6 et l’IL-17 sont des médiateurs essentiels dans des maladies telles que la PR et le psoriasis. La famille des IL-1, dont l’IL-1β et l’IL-18, aggrave encore plus les lésions tissulaires en activant l’inflammasome NLRP3, un mécanisme impliqué dans l’apparition du LES2,3. Non seulement ces cytokines provoquent des inflammations locales, mais elles contribuent également à des manifestations systémiques, telles que la fièvre et la fatigue, par leur action sur l’axe hypothalamo-hypophyso-surrénalien.4.
Déficits en cytokines régulatrices
Les cytokines immunosuppressives, telles que l’IL-10 et le TGF-β, contrebalancent les signaux pro-inflammatoires. L’IL-10, produite par les Breg et les Treg, inhibe la présentation d’antigène et supprime les réponses Th1/Th175,6. Dans le LES, une production réduite de l’IL-10 par les Breg est associée aux poussées de la maladie, ce qui souligne son rôle de protecteur6. À l’inverse, le TGF-β maintient la tolérance périphérique en induisant la différenciation des Treg et en supprimant la prolifération des cellules T effectrices3. La dérégulation de ces voies régulatrices crée un environnement immunitaire permissif, comme dans les cas de PR et de sclérose en plaques (SEP), où une signalisation du TGF-β défectueuse conduit à une activité non contrôlée des lymphocytes Th173,7.
Déséquilibre des cytokines et boucles de rétroaction
Les maladies auto-immunes sont souvent caractérisées par des boucles de rétroaction cytokiniques autoalimentées. Par exemple, l’IL-6 renforce la différenciation des lymphocytes Th17 tout en inhibant le développement des Treg, ce qui crée un cycle pathogène qui perpétue l’inflammation7. Dans le psoriasis, l’IL-23, produite par les cellules dendritiques, favorise la survie des Th17, qui à leur tour sécrètent de l’IL-17 et de l’IL-22, contribuant à l’activation des kératinocytes et des cellules stromales8. Ces boucles sont en outre exacerbées par les cellules résidant dans les tissus tels que les fibroblastes synoviaux dans la PR, qui produisent ensuite des chimiokines comme la CXCL13. Il en résulte un recrutement des lymphocytes B et des plasmocytes, ce qui favorise la formation de structures lymphoïdes ectopiques7.
Ciblage thérapeutique des réseaux des cytokines
Traitements biologiques
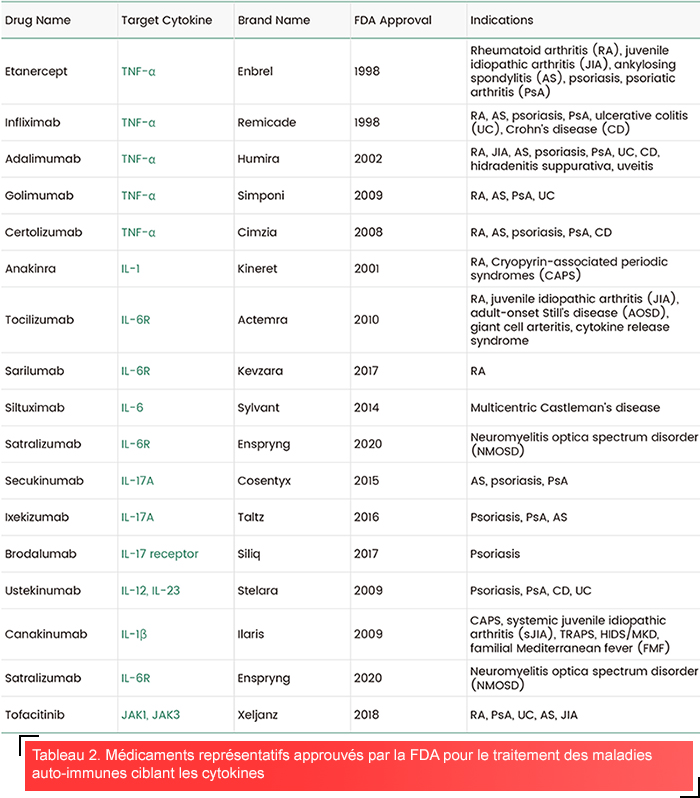
Agents inhibiteurs de TNF-α : Les inhibiteurs de TNF (tels que l’infliximab ou l’adalimumab) ont permis de révolutionner le traitement de la PR en réduisant la synovite et la progression radiographique7. Cependant, le caractère pléiotropique des cytokines signifie que le blocage des TNF peut paradoxalement induire des lésions psoriasiformes chez certains patients8.
Inhibition de l’IL-6 : Le tocilizumab, un antagoniste des récepteurs de l’IL-6, agit favorablement sur l’inflammation systémique dans la PR et l’arthrite juvénile idiopathique (AJI)7. L’inhibition de l’IL-6 laisse présager de bonnes perspectives dans le traitement des troubles du spectre de la neuromyélite optique (TSNO), en réduisant la fréquence des rechutes.
Ciblage de l’axe IL-17/IL-23 : Le sécukinumab (inhibiteur de l’IL-17A) et l’ustékinumab (inhibiteur de l’IL-12/23p40) permettent d’obtenir une clairance cutanée rapide dans le psoriasis en perturbant la signalisation Th178. Le brodalumab, qui cible les récepteurs de l’IL-17, est efficace dans l’arthrite psoriasique8.
Inhibition de JAK/STAT
Les inhibiteurs de JAK (jakinibs) modulent la signalisation des cytokines en bloquant la phosphorylation en aval des STAT. Le tofacitinib (inhibiteur de JAK1/3) et le baricitinib (inhibiteur de JAK1/2) sont approuvés pour le traitement de la PR, en inhibant les voies IFN-γ, IL-6 et GM-CSF9. Dans le LES, les inhibiteurs de JAK réduisent la signature IFN-α et agissent favorablement sur la néphrite, offrant ainsi une alternative à l’immunosuppression généralisée9.
Immunothérapies à base d’IL-2
L’administration de faibles doses d’IL-2 augmente le taux de Treg et rétablit la tolérance immunitaire dans le LES et le diabète de type 110. Les variantes d’IL-2 conçues pour une spécificité Treg accrue (par exemple, les complexes IL-2/anti-IL-2) permettent d'obtenir des résultats prometteurs dans les modèles précliniques, bien que leur efficacité dans les essais cliniques reste variable.10,11.
Modulation des micro-ARN
Les micro-ARN régulent la production de cytokines par voie post-transcriptionnelle. Le miR-155 favorise la production de TNF-α et d’IL-6 dans la synoviale affectée par la PR, tandis que le miR-146a inhibe par rétroaction la signalisation NF-κB12. Les anti-miR ciblant le miR-155 réduisent la gravité de la maladie dans l’encéphalomyélite auto-immune expérimentale (EAE), ce qui met en évidence le potentiel des thérapies basées sur les micro-ARN12.
Cytokines de synthèse
La synthèse des cytokines vise à en améliorer la spécificité thérapeutique. L’IL-10 pégylée (AM0010) prolonge la demi-vie des cytokines et permet de réduire la colite dans les modèles précliniques11. De même, les protéines de fusion IL-4 favorisent la polarisation des macrophages vers un phénotype anti-inflammatoire, ce qui ouvre l’accès à de nouvelles stratégies pour le traitement des maladies caractérisées par la fibrose, telles que la sclérose systémique.11.
Résumé basé sur l’article de Jung S. et Kim W13.
Abréviations :
PR : Polyarthrite Rhumatoïde
SA : Spondylarthrite Ankylosante
PsA: Arthrite Psoriasique
RH : Rectocolite Hémorragique
MC : Maladie de Crohn
AJI : Arthrite Juvénile Idiopathique
pAJI : Polyarthrite Juvénile Idiopathique
FMF : Fièvre Méditerranéenne Familiale
TSNO : Trouble du Spectre de la Neuromyélite Optique
Conclusion
Les progrès dans le domaine de la biologie des cytokines ont permis de mettre en évidence des signatures spécifiques à certaines maladies, ce qui a ouvert la voie à des thérapies de précision ciblant des nœuds clés au sein de ces réseaux. Malgré les succès obtenus, des défis demeurent, notamment la redondance des cytokines, la pléiotropie et l’hétérogénéité inter-patient. Les recherches futures peuvent être orientées vers les interventions portant sur le microbiome, le profilage personnalisé des cytokines et les produits biologiques modifiés pour obtenir une spécificité accrue du type de cellule. Les progrès futurs dans le domaine de l’auto-immunité reposent sur l’exploitation du réseau des cytokines dans le but de rétablir l’équilibre immunitaire, en intégrant les connaissances des mécanismes d’interaction aux thérapies innovantes.
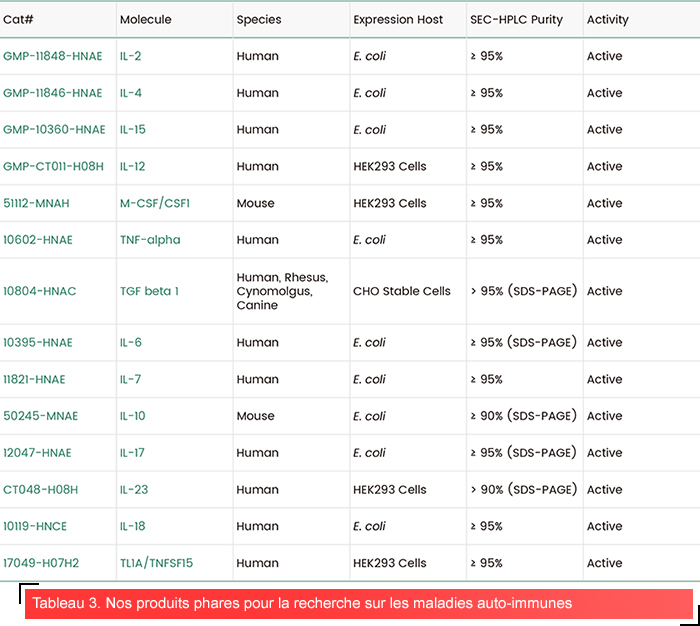
Pour soutenir la recherche ciblée et le développement de médicaments contre les maladies auto-immunes, Sino Biological propose une gamme de cytokines de haute qualité. Nos produits sont soumis à un contrôle qualité rigoureux afin de garantir un haut niveau de pureté, de bioactivité, de stabilité et de faibles taux d’endotoxines, avec des options disponibles pour plusieurs espèces, notamment l’homme, la souris, le singe et le rat. En outre, Sino Biological fournit des solutions complètes pour les maladies auto-immunes, en proposant une large gamme de réactifs de recherche pour près de 50 maladies. Notre portefeuille comprend des réactifs cibles pour les maladies auto-immunes tels que les protéines cibles, les cytokines et les kinases, ainsi que des réactifs de recherche pour les études de biomarqueurs. En fournissant des outils de haute qualité pour l’analyse des biomarqueurs et la découverte de nouveaux médicaments, Sino Biological joue un rôle crucial dans l’amélioration des techniques de détection précoce et le développement de thérapies ciblées pour les maladies auto-immunes.
References (H2)
1. Yasmeen, F., Pirzada, R. H., Ahmad, B., Choi, B. & Choi, S. Understanding Autoimmunity: Mechanisms, Predisposing Factors, and Cytokine Therapies. International Journal of Molecular Sciences vol. 25 Preprint at https://doi.org/10.3390/ijms25147666 (2024).
2. De Paepe, B. & Zschüntzsch, J. Scanning for Therapeutic Targets within the Cytokine Network of Idiopathic Inflammatory Myopathies. Int J Mol Sci 16, 18683 (2015).
3. Leung, S. et al. The cytokine milieu in the interplay of pathogenic Th1/Th17 cells and regulatory T cells in autoimmune disease. Cell Mol Immunol 7, 182 (2010).
4. Biscetti, L. et al. Headache and immunological/autoimmune disorders: a comprehensive review of available epidemiological evidence with insights on potential underlying mechanisms. J Neuroinflammation 18, 259 (2021).
5. De Gruijter, N. M., Jebson, B. & Rosser, E. C. Cytokine production by human B cells: role in health and autoimmune disease. Clin Exp Immunol 210, 253 (2022).
6. Lino, A. C., Dörner, T., Bar-Or, A. & Fillatreau, S. Cytokine-producing B cells: a translational view on their roles in human and mouse autoimmune diseases. Immunol Rev 269, 130–144 (2016).
7. Kondo, N., Kuroda, T. & Kobayashi, D. Cytokine Networks in the Pathogenesis of Rheumatoid Arthritis. International Journal of Molecular Sciences 2021, Vol. 22, Page 10922 22, 10922 (2021).
8. WOJAS-PELC, A., CISZEK, M., KURNYTA, M. & MARCINKIEWICZ JANUSZ. Cytokine network in psoriasis. Cross-talk between keratinocytes and cells of the skin immune system. (2006).
9. Kotyla, P., Gumkowska-Sroka, O., Wnuk, B. & Kotyla, K. Jak Inhibitors for Treatment of Autoimmune Diseases: Lessons from Systemic Sclerosis and Systemic Lupus Erythematosus. Pharmaceuticals 15, 936 (2022).
110. Raeber, M. E., Sahin, D., Karakus, U. & Boyman, O. A systematic review of interleukin-2-based immunotherapies in clinical trials for cancer and autoimmune diseases. EBioMedicine 90, 104539 (2023).
111.Deckers, J. et al. Engineering cytokine therapeutics. Nature Reviews Bioengineering 1, 286 (2023).
12. Salvi, V., Gianello, V., Tiberio, L., Sozzani, S. & Bosisio, D. Cytokine targeting by miRNAs in autoimmune diseases. Front Immunol 10, 435194 (2019).
13. Jung, S. M. & Kim, W. U. Targeted Immunotherapy for Autoimmune Disease. Immune Network vol. 22 Preprint at https://doi.org/10.4110/in.2022.22.e9 (2022).