Émergence des anticorps bispécifiques et leurs cibles dans l'immunothérapie du cancer aux stades de la découverte, du développement, de la phase préclinique et de la phase clinique
Les anticorps monoclonaux ont contribué à la révolution de la thérapie anticancéreuse depuis leur introduction dans ce domaine. Pour améliorer la spécificité et les capacités des anticorps, des anticorps bispécifiques (AcBs) sont apparus, pouvant lier deux antigènes différents ou deux épitopes différents sur le même antigène. Plus de 85 % des AcBs faisant l'objet d'essais cliniques sont des traitements contre le cancer.
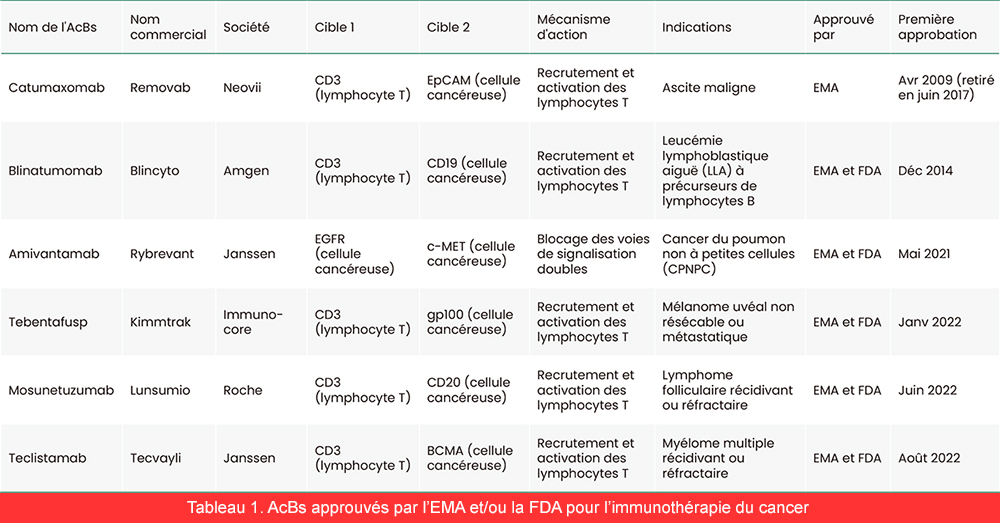
En 2022, 6 AcBs avaient été approuvés par l'EMA et/ou la FDA pour l'immunothérapie du cancer (tableau 1), dont le premier AcBs approuvé, le Catumaxomab, qui a été retiré du marché de l'Union européenne en 2017, et 3 AcBs approuvés pour une mise sur le marché en 2022. D'ici à la fin de 2023, des demandes d'autorisation de mise sur le marché pourraient être déposées pour 5 AcBs en phase finale d'études cliniques. Avec plus de 600 AcBs actuellement à l'étude, l'industrie devrait atteindre plus de 30 milliards de dollars au cours des cinq prochaines années. C'est pourquoi les grandes sociétés pharmaceutiques s'intéressent de plus en plus à l'exploration et à l'investissement dans cette immunothérapie qui présente le plus grand potentiel thérapeutique.
Mécanismes d'action des AcBs et nouvelles cibles
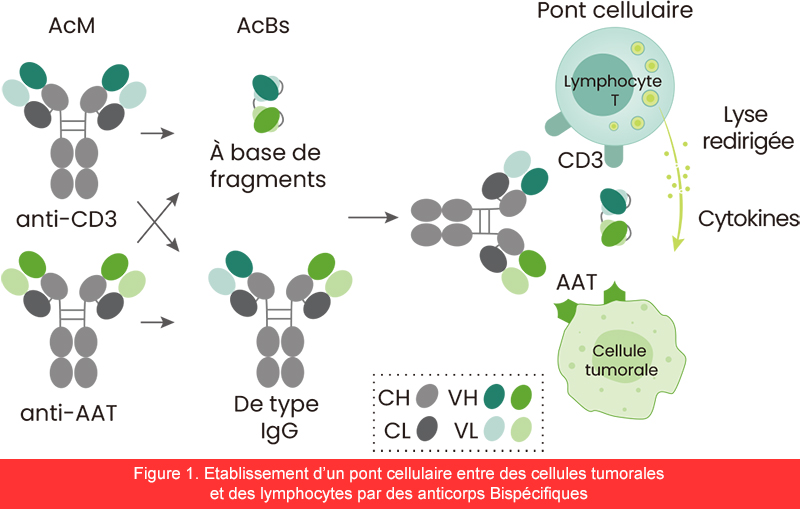
Il existe différentes catégories d'AcBs en fonction de leurs mécanismes d'action. Un grand nombre d'AcBs ont été conçus pour établir un pont entre les cellules tumorales et les lymphocytes T. Ils se lient simultanément à un antigène associé à la tumeur (AAT) exprimé sur les cellules tumorales et au CD3 sur les lymphocytes T, redirigeant l'activité cytotoxique des lymphocytes T effecteurs afin d'éliminer spécifiquement les cellules tumorales (figure 1). Les AAT ciblés par les AcBs de liaison cellulaire approuvés sont EpCAM, CD19, gp100, CD20 et BCMA. Outre les AcBs déjà approuvés, les antigènes associés à la tumeur des AcBs de liaison cellulaire qui sont actuellement testés dans des essais cliniques comprennent CD123, CD33, CD37, CD38, CLEC12A et FLT-3 pour les hémopathies malignes ainsi que CEA, HER2, PSMA, PMEL, B7H3, GPA33 et GPC3 pour les tumeurs solides. Outre les lymphocytes T, les cellules NK peuvent également être effectrices dans la liaison cellulaire par les AcBs. Le CD16 des cellules NK est souvent utilisé comme cible pour cette catégorie d'AcBs. Par exemple, les AcBs ciblant CD30×CD16 font actuellement l'objet d'essais cliniques pour les hémopathies malignes.
Les AcBs bloquant deux voies de signalisation mutuellement liées en ciblant deux épitopes sur les cellules tumorales ou dans le microenvironnement tumoral, sont également largement étudiés. Les paires d'antigènes comprennent EGFR×c-MET, VEGF×Ang-2, VEGF×DLL4, IGFâ1×IGFâ2, HER2×HER3 et HER2×HER2. En mai 2021, la FDA a approuvé l'amivantamab (Rybrevant) de Janssen ciblant l'EGFR×c-MET pour le traitement du cancer du poumon non à petites cellules (CPNPC).
Les AcBs bloquant les checkpoints immunitaires, tels que PD-L1×CTLA-4, PD-1×LAG3, et PD-L1×TIGIT, en sont une autre catégorie testée dans les essais cliniques. Les checkpoints immunitaires ont un effet inhibiteur sur l'activité des cellules immunitaires. Les AcBs ciblant simultanément deux checkpoints immunitaires sont principalement étudiés pour le traitement des tumeurs solides et améliorent potentiellement l'efficacité de l'inhibition des checkpoints par rapport à la monothérapie. En juin 2022, le Cadonilimab (å¼å¦å°¼®) d'Akeso, un inhibiteur de PD-1×CTLA-4, a été approuvé en Chine pour le traitement du cancer du col de l'utérus récidivant ou métastatique. Il s'agit du premier AcBs à double inhibiteur de checkpoint immunitaire approuvé. Des AcBs de checkpoints immunitaires combinés à des AAT ont également été développés, notamment PD1×HER2 et PD1×VEGF. De plus, des AcBs ciblant conjointement les checkpoints immunitaires et les molécules costimulantes des lymphocytes T, notamment PD-L1×4-1BB (CD137) et CTLA-4×OX40 (CD134), sont en cours de développement.
AcBs et cibles au-delà du cancer
Après le succès rencontré en oncologie, des recherches sur les AcBs sont menées pour le traitement d'autres maladies, notamment les maladies auto-immunes, les infections, les maladies neurologiques, les troubles ophtalmiques et les maladies rares. Depuis l'approbation par la FDA de l'Emicizumab (Hemlibra) de Roche pour l'hémophilie A en 2017, qui agit sur le facteur de coagulation IXa (FIXa)×FX, de nouvelles voies ont été ouvertes pour l'application des AcBs dans d'autres maladies. En janvier 2022, la FDA a approuvé le faricimab (Vabysmo) de Genentech, qui cible le VEGF×Ang-2, pour traiter la DMLA humide et l'OMD.
Puis, en septembre 2022, l'Ozoralizumab (Nanozora) de Taisho Pharmaceutical, un composé NANOBODY® trivalent humanisé composé de deux NANOBODIES® anti-TNFα et d'un NANOBODY®, anti-HSA, a été approuvé au Japon pour le traitement de la polyarthrite rhumatoïde (PR). Dans le domaine des maladies auto-immunes, les cibles des AcBs en cours de développement sont notamment CD32B, CD79B, TNF, IL-17A, IL-4, IL-13, IL-1α, IL-1β et IL-17F.
Le succès rapide des AcBs dans les programmes de lutte contre le cancer et d'autres maladies a suscité beaucoup d'attention et d'investissements pour faire progresser ce domaine thérapeutique. Grâce aux recherches en cours aux stades de la découverte, de la phase préclinique et de la phase clinique, la thérapie par AcBs a un avenir très prometteur et apporte de l'espoir aux patients souffrant de ces différentes maladies qui n'ont pas beaucoup d'options thérapeutiques.
Soutien au développement d'anticorps bispécifiques chez Sino Biological
En tant que leader mondial de la technologie recombinante, Sino Biological est à l'avant-garde des secteurs des bioréactifs et des services à façon (CRO). Sino Biological a développé une grande variété de protéines recombinantes et d'anticorps de très haute qualité pour soutenir la recherche et le développement thérapeutique de cibles d'anticorps bispécifiques en immunothérapie et dans d'autres maladies.
Ses produits phares comprennent des protéines de haute pureté d’activité pour CD3, CD16a, CD38, CD278/ICOS, CTLA-4, HER2, HER3, c-MET, VEGFR2, DLL4, TIGIT, 4-1BB, et bien d'autres cibles bien établies et émergentes.
Sino Biological fournit également un service de production d'anticorps bispécifiques rapide et efficace sur la base de son expertise et de son expérience étendues en matière d'expression dans des cellules de mammifères et de plateformes technologiques exclusives spécifiquement optimisées. À partir de la séquence de l'anticorps, Sino Biological peut fournir plusieurs formats d'AcBs, tels que BiTE, Diabody, CrossMab et DVD-IgG. De nombreux projets d'AcBs ont été menés à bien avec un taux de réussite global supérieur à 90 %, et des rendements de 250 mg/L ou plus ont été atteints.
Références
1. Jin S, Sun Y, Liang X, et al. Emerging new therapeutic antibody derivatives for cancer treatment. Signal Transduct Target Ther. 2022;7(1):39. Published 2022 Feb 7. doi:10.1038/s41392-021-00868-x
2. Kang J, Sun T, Zhang Y. Immunotherapeutic progress and application of bispecific antibody in cancer. Front Immunol. 2022;13:1020003. Published 2022 Oct 20. doi:10.3389/fimmu.2022.1020003
3. Kaplon H, Crescioli S, Chenoweth A, Visweswaraiah J, Reichert JM. Antibodies to watch in 2023. MAbs. 2023;15(1):2153410. doi:10.1080/19420862.2022.2153410
4. Carrasco-Padilla C, Hernaiz-Esteban A, Álvarez-Vallina L, Aguilar-Sopeña O, Roda-Navarro P. Bispecific Antibody Format and the Organization of Immunological Synapses in T Cell-Redirecting Strategies for Cancer Immunotherapy. Pharmaceutics. 2022;15(1):132. Published 2022 Dec 30. doi:10.3390/pharmaceutics15010132
5. Nick T. The accelerating rise of bispecific antibodies outside of oncology. Biopharm Deal. Published 2018 Sep 28. https://www.nature.com/articles/d43747-020-00566-7
6. Sheridan C. Bispecific antibodies poised to deliver wave of cancer therapies. Nat Biotechnol. 2021;39(3):251-254. doi:10.1038/s41587-021-00850-6
7. Wang S, Chen K, Lei Q, et al. The state of the art of bispecific antibodies for treating human malignancies. EMBO Mol Med. 2021;13(9):e14291. doi:10.15252/emmm.202114291